¡¡¡¡ADVERTENCIAS!!!
1- En esta entrada se usan una serie de instrumento que son fruto de la imaginación del autor: La “nanobalanza” (1), la “lupa de efecto túnel” (2), y la “máquina contadora de átomos y moléculas”(3). Todos ellos de la marca ACME(4)
2- Para comprender esta entrada, se debe conocer la teoría atómica de Dalton.
ACTIVIDAD 1
Con la ayuda de la “lupa de efecto túnel” puedes visualizar una “nanobalanza” (hecha con unos pocos átomos). Usa la “nanobalanza” para comparar la masa de diferentes átomos y moléculas con la masa de un átomo de hidrógeno .¿Cuántos átomos de hidrógeno hacen falta para equilibrar la balanza en cada caso?
Escribe en tu cuaderno y completa:
La masa de un átomo de azufre es igual a la masa de 32 átomos de hidrógeno.
La masa de un átomo de carbono es igual a la masa de ___ átomos de hidrógeno.
La masa de un átomo de oxígeno es igual a la masa de ___ átomos de hidrógeno.
La masa de un átomo de__________ es igual a la masa de ___ átomos de hidrógeno
etc.
La masa de una molécula de _________ es igual a la masa de ___ átomos de hidrógeno
etc.
En esta actividad has usado la masa de un átomo de hidrógeno como patrón para medir
la masa de átomos y moléculas pero el patrón que usan los químicos es la unidad de masa atómica (u.m.a.), que se define como:
La doceava parte de la masa del átomo de carbono 12 (5)
Para la Física esta definición no es suficiente precisa y definen la unidad de masa atómica unificada :
“ La doceava parte de la masa de un átomo neutro y no enlazado de carbono 12 en su estado fundamental eléctrico y nuclear”
Complicado ¿Verdad?. Nos basta con la primera definición pero sí usaremos las unidades y símbolos.
Unidad de masa atómica unificada (u) o Dalton (Da).
Por la definición un átomo de carbono tiene una masa de 12 u y en la "nanobalanza" hemos visto que la masa de un átomo de carbono es igual a la masa de 12 átomos de carbono, lo que implica que un átomo de hidrógeno tiene una masa de 1 u o 1 Da.
No todos los átomos de carbono tienen una masa de 12 u, el 1,07 %, tienen una masa de 13 u.
Llamamos masa atómica relativa, Ar(símbolo del elemento), al valor medio, teniendo en cuenta su abundancia, de la masa (expresada en u o Da) de los átomos de un elemento.
En tu sistema periódico tienes la masa atómica de cada elemento.
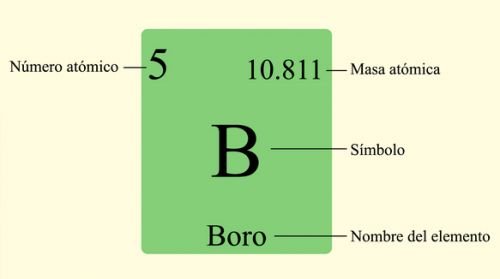
Imagen de significados.com
Ar(B)=10,8 u;
ACTIVIDAD 2
Para calcular la masa molecular sumamos la masa atómica relativa de todos los átomos que la integran
Calcula la masa de molecular de los compuestos de la interacción. Usa las siguientes masas atómicas: Ar(H) =1 u; Ar(O)= 16 u; Ar(N)=14 u; Ar(Cl)=35,5 u; Ar(S)=32 u;
Ar(Cu)=63,5 u; Ar(C))=12 u
Ejemplo :Ar(H2O) = 2 X Ar(H)+ Ar(O) = 2 X 1 u + 16 u = 18 u
 |  |
 | |
 |  |  | |
ACTIVIDAD 3
Esta actividad, aparentemente ajena al tema que tratamos, te ayudará a comprender algunos conceptos muy importantes en química:
La afamada empresa ACME fabrica diferentes objetos y los distribuye en paquetes de un millar. Suponemos que la masa del material de embalaje es despreciable.
Pesa cada uno de los objetos en la balanza y anota su masa luego pesa los paquetes de 1000 unidades en la báscula y también anota su masa.
¿En qué se parecen las medidas del laboratorio y las del almacén? ¿En qué se diferencian?
ACTIVIDAD 4
La u.m.a. es una unidad de masa tan pequeña que no podemos usarla en los laboratorios de Química.
En los laboratorios de la factoría ACME pesan en g y en el almacén en Kg pero el número que indica la masa de un lápiz y de un millar de lápices en kg es el mismo, sólo cambia la unidad.
Qué número de átomos o de moléculas deberemos coger para que el número que expresa la masa de un átomo o una molécula en u.m.a. sea el mismo que expresa esa cantidad de átomos o moléculas en g?
Tienes distintas masas de diferentes sustancias.
El mismo número de g que que el número que indica la masa del un átomo o molécula en en uma.
¿Cuántos átomos o moléculas hay en cada caso?
Usa la “máquina contadora de átomos y moléculas” para averiguarlo.
NA= 6,022 ×1023 mol-1
El mol, símbolo mol, es la unidad SI de cantidad de sustancia. Un mol contiene 6,022 × 1023 entidades elementales
Las cantidades utilizadas para caracterizar una muestra de una sustancia química pura X son:
n - la cantidad de sustancia en la muestra de X;
N - el número de entidades elementales de la sustancia X en la muestra;
m - la masa de las N entidades elementales;
Ar (X) - la masa atómica o molecular relativa de X (4) (en caso de que X sea un elemento o compuesto, respectivamente)
Mu - la constante de masa molar = 1 g/mol
Las ecuaciones que relacionan estas cantidades son:
n = m /Ar(X) ∗ Mu
n = N/ NA
(1) “Nanobalanza”:
Actualmente la tecnología permite construir objetos simples del tamaño de 10-9 m ("nanotecnología").
En esta web suponemos que es posible construir una balanza estas dimensiones con átomos individuales.(Todo se construye con átomos)
Posiblemente la “nanobalanza” no funcione adecuadamente ya que a esta escala las fuerzas de repulsión y de atracción entre átomos, son más importantes que la fuerza de la gravedad.
(2) “Lupa de efecto túnel”:
Para observar un objeto es necesario que la luz interaccione con él. Para que esto ocurra, el tamaño del objeto debe ser, por lo menos, del mismo orden que la longitud de onda de la luz.
Como el tamaño de los átomos es del orden de 10-10 m, es decir, 1000 veces más pequeños que la longitud de onda de la luz visible, ésta no interacciona con los átomos y por tanto ningún instrumento óptico, por muy potente que sea, puede permitirnos ver los átomos.
Para poder visualizar los átomos se utiliza el microscopio de efecto túnel. Su funcionamiento es el siguiente:
a) Un punzón, tan afilado que tiene en la punta un solo átomo, se mueve por la zona a estudiar mediante un sistema de guía automático.
b) Una propiedad de los átomos llamada densidad electrónica crea en el punzón una débil corriente eléctrica por un fenómeno denominado "efecto túnel".
c) Dicha corriente eléctrica es amplificada y enviada a un ordenador junto a los datos de posición del punzón.
d) Con estos datos el ordenador crea una imagen artificial, asignando distintos colores a distintas intensidades de corriente.
En esta entrada suponemos que podemos montar dicho microscopio en una lupa.
(3)"La máquina contadora de átomos y moléculas"
Es capaz de contar un millón de átomos o de moléculas en cada segundo... Y a pesar de ello deberás tenerle algo de paciencia.
4) “La factoría ACME”
Un homenaje a Wile E. Coyote, el antihéroe de la generación del autor.

No hay comentarios:
Publicar un comentario